Соланин и чаконин
Все растения семейства пасленовых, к которому относятся томаты, картофель и баклажаны, содержат природные токсины соланин и чаконин (гликоалкалоиды). Как правило, концентрация этих веществ в растениях невысока. Тем не менее, в более высокой концентрации они присутствуют в побегах картофеля и кожуре и зеленоватых частях его клубней, имеющих горький привкус, а также в зеленых томатах. Растения вырабатывают токсин в ответ на внешний раздражитель, такой как механическое повреждение, ультрафиолетовое излучение, колонизация микроорганизмами и нападение со стороны насекомых-вредителей и травоядных животных
Для предупреждения возникновения соланина и чаконина в картофеле важно хранить клубни в темном, прохладном и сухом месте. Также не рекомендуется употреблять в пищу позеленевшие или пускающие ростки части клубней.
Что такое природные токсины?
Природные токсины – это токсичные вещества природного происхождения, вырабатываемые некоторыми видами живых организмов. Эти токсины не опасны для вырабатывающих их организмов, но могут быть токсичны для других, в том числе для человека, в случае их приема с пищей. Эти химические вещества имеют разнообразную структуру и различаются по биологической функции и степени токсичности.
Некоторые токсины вырабатываются растениями и играют роль защитного механизма против хищников, насекомых или микроорганизмов или же образуются в результате поражения растений микроорганизмами, такими как плесневые грибы, вследствие климатического стресса (засуха или чрезвычайно высокая влажность).
Другими источниками природных токсинов являются микроскопические водоросли и планктон, обитающие в океанах и иногда озерах и вырабатывающие химические вещества, токсичные для человека, но не для рыб или моллюсков, питающихся этими организмами. В случае употребления человеком рыбы или моллюсков, содержащих эти токсины, может быстро наступить неблагоприятная реакция.
Ниже приводится описание некоторых природных токсинов, наиболее часто встречающихся в продуктах питания и создающих угрозу для нашего здоровья.
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Ядовитые грибы
Дикорастущие грибы могут содержать ряд токсинов, например, мусцимол и мускарин, которые могут вызывать рвоту, диарею, спутанность сознания, нарушения зрения, повышенное слюноотделение и галлюцинации. Симптомы начинают проявляться через 6–24 часа после употребления грибов в пищу. Обычно для смертельного отравления характерно позднее развитие тяжелых симптомов, свойственных поражению печени, почек и нервной системы. Чистка и термическая обработка грибов не позволяют ликвидировать содержащиеся в них токсины. Рекомендуется избегать употребления в пищу любых дикорастущих грибов при отсутствии полной уверенности в их безвредности.
Пищевые кислоты и кислотность продуктов
Кислый вкус пищевого продукта обусловливают ионы водорода, образующиеся в результате электролитической диссоциации содержащихся в нем кислот и кислых солей. Активность ионов водорода (активная кислотность) характеризуется показателем рН (отрицательный логарифм концентрации водородных ионов). Значения рН для некоторых жидких пищевых продуктов представлены ниже:
- Апельсиновый сок 3,2–3,5
- Ананасовый сок 3,6
- Виноградный сок 3,2
- Грейпфрутовый сок 3,1
- Банановый нектар 3,6–3,7
- Пиво 4,2–4,6
- Цельное молоко 6,6–6,8
- Сгущенное молоко 6,1–6,4
- Йогурт 4,0–4,3
- Какао (напиток) 6,3–6,4
Практически все пищевые кислоты являются слабыми и в водных растворах диссоциируют незначительно (константы диссоциации см. в табл. 3). Кроме того, в пищевой системе могут находиться буферные вещества, в присутствии которых активность ионов водорода будет сохраняться примерно постоянной из-за ее связи с равновесием диссоциации слабых электролитов. Примером такой системы является молоко.
Таблица 3. Свойства основных пищевых кислот
| Кислота | Эмпирическая
формула |
Молекулярная
масса |
Температура
плавления,°C |
Растворимость,
г/100 мл Н2О при 25°С |
Константа
диссоциации |
Показатель
константы кислотности рКа, при 25°С |
| Уксусная | С2Н4О2 | 60,05 | 16,75 | Смешивается | 1,76 · 10-5 | 4,75 |
| Молочная | С3Н6О3 | 90,08 | 16,8 | Хорошо
растворим |
1,37 · 10-4 | 3,86 |
| Лимонная | С6Н8О7 | 192,12 | 153
(безв.) |
181,0 | К1 = 7,1 · 10-4 | 3,14 (при +20°С) |
| К2=1,68 · 10-5 | 4,77 (при +20°С) | |||||
| К3 = 6,4 · 10-7 | 6,39 (при +20°С) | |||||
| Яблочная | С4Н6О5 | 134,09 | 132 | 62,0 | К1 = 3,9 · 10-4 | 3,40 |
| К2 = 7,8 · 10-6 | 5,11 | |||||
| Винная | С4Н6О6 | 150,09 | 168-170 | 147,0 | К1 = 1,04 · 10-3 | 2,98 |
| К2 = 4,55 · 10-5 | 4,34 | |||||
| Янтарная | С4Н6О4 | 118,09 | 188 | 6,8 | К1 = 6,5 · 10-5 | 4,21 |
| К2 = 2,3 · 10-6 | 5,64 | |||||
| Янтарный
ангидрид |
С4Н4О3 | 100,07 | 118,3 | Малорастворим | К1= 6,5 · 10-5 | |
| К2 = 2,3 · 10-6 | ||||||
| Адипиновая | С6Н10О4 | 146,14 | 152 | 1,9 (при +20°С) | К1 =3,71 · 10-5 | 4,43 |
| К2 = 3,87 · 10-6 | 5,41 | |||||
| Фумаровая | С4Н4О4 | 116,07 | 286 | 0,5 (при +20°С) | К1 = 9,3 · 10-4 (при + 18°С) | 3,03 (при +18°С) |
| К2 = 3,62 · 10-5(при +18°С) | 4,44 (при + 18°С) | |||||
| Глюконодельта-лактон | С6Н10О6 | 178,14 | 153 | 59,0 | К1 = 1,99 · 10-4 (для кислоты) | 3,70 (для кислоты) |
| Фосфорная | H3РО4 | 98,00 | 42,35 | Хорошо растворим в горячей воде | К1 = 7,52 · 10-3 | 2,12 |
| К2 = 6,23 · 10-8 | 7,21 | |||||
| К3 = 2,2 · 10-13 (при +18°С) | 12,67 |
В связи с этим суммарная концентрация в пищевом продукте веществ, имеющих кислотный характер, определяется показателем потенциальной, общей или титруемой (раствором щелочи) кислотности. Для разных продуктов эта величина выражается через различные показатели. Например, в соках определяют общую кислотность в граммах на 1 л, в молоке — в градусах Тернера и т. д.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
Рейтинг: 5/5 — 2
голосов
Похожие публикации
Пищевая добавка Е297 — важный компонент пищевой промышленности
Формиат натрия: характеристика, свойства и применение
Молочная кислота как пищевая добавка E270
Методы определения кислот в пищевых продуктах
В основе определения рН различных пищевых систем лежат стандартные методы, описанные в руководствах по аналитической химии. К ним относятся калориметрический и электрометрический методы.
Определение потенциальной кислотности, характеризующей общее содержание веществ, имеющих кислотный характер, основано на титровании этих веществ сильными основаниями (щелочами). Для различных пищевых продуктов характерны свои особые условия титрования, результаты которых представляют в соответствующих кислотных числах.
Анализ кислотного состава пищевого продукта дает возможность обнаружить фальсификацию или подтвердить его натуральность. Для определения содержания органических кислот используют как стандартные, так и альтернативные методы контроля.
Официальный метод анализа молочной кислоты основан на ее окислении перманганатом калия до уксусного альдегида, который определяют йодометрически. Наиболее известные методы определения винной кислоты базируются на щелочном титровании выпадающего винного камня. Большинство органических кислот можно определить хроматографическими методами.
К альтернативным относятся методы, основанные на использовании ферментативных систем. Характерными особенностями ферментативного анализа являются специфичность, обеспечивающая достоверность результатов, высокие точность и чувствительность.
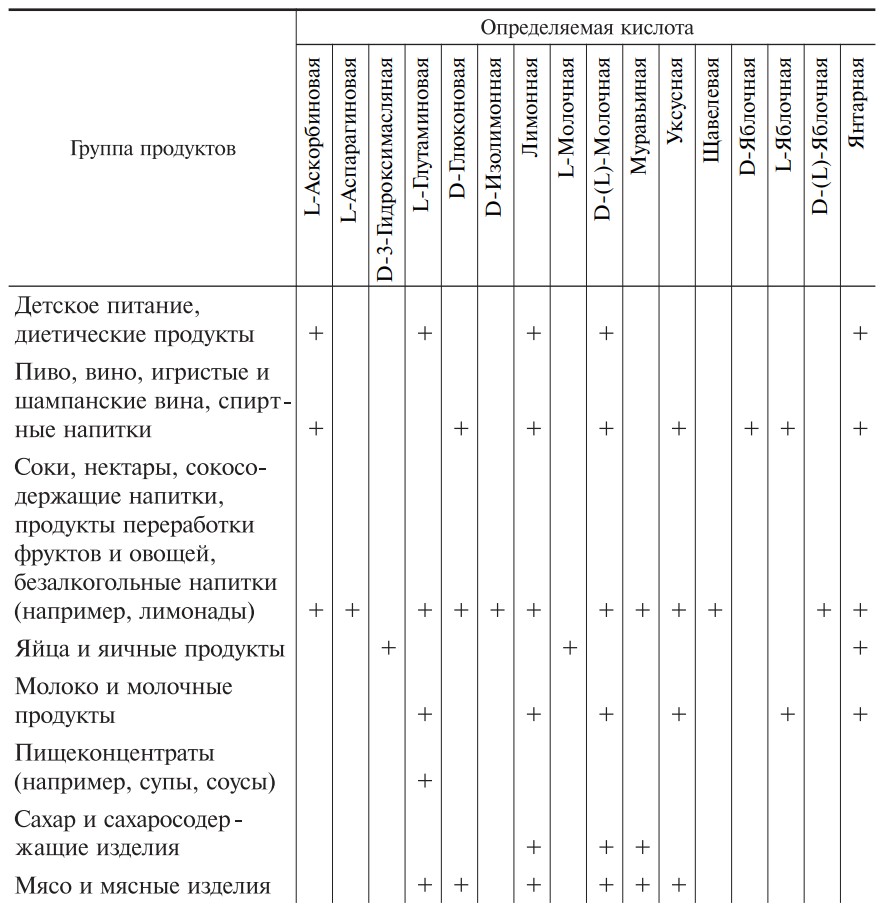
Перечень органических кислот в составе пищевых продуктов, определяемых ферментативными методами, представлен в табл. 4.
Использование ферментативных методов в аналитической химии органических пищевых кислот, в зависимости от группы анализируемых продуктов, может иметь различные цели, к которым относятся:
- производственный контроль;
- системы обеспечения качества;
- контроль качества готовой продукции;
- контроль сырья;
- оценка качества;
- анализ состава с целью установления пищевых свойств и их соответствия нормативной документации;
- оценка гигиенического статуса;
- мониторинг качества;
- выявление нежелательных компонентов;
- установление фальсификации;
- определение доли натурального сырья;
- определение аутентичности (подлинности).
Таблица 4. Пищевые кислоты в составе различных продуктов питания, определяемые ферментативными методами
Просмотров:
1 170
Процесс усвоения веществ
Как отмечали ранее, глюкозамин и хондроитин во многих продуктах содержатся в связанном состоянии и плохо усваиваются. Молекула хондроитина сульфата крупнее молекулы глюкозамина в сотню раз, а биодоступность составляет около 15-20%. Глюкозамин содержит в себе глюкозное ядро, которое как проводник, повышает усвояемость до 41%.
Поэтому, для укрепления суставов в первую очередь необходимо начать правильно питаться.
Не стоит заниматься самолечением, если появились жалобы:
- хруст;
- боль во время движений;
- утренняя скованность;
- ограничение движений;
- отек;
- гиперемия кожи над суставами.
В этом случае только специалист индивидуально подберет терапию, направленную на уменьшение воспаления и боли, восстановление хрящевого каркаса и, следовательно, двигательной функции.
Цианогенные гликозиды
Цианогенные гликозиды – это фитотоксины (т.е. токсические соединения, вырабатываемые растениями), встречающиеся в составе по меньшей мере 2000 видов растений, многие из которых употребляются в пищу в некоторых регионах мира. К наиболее массово потребляемым продуктам питания, содержащим цианогенные гликозиды, относятся кассава, сорго, ядра косточковых плодов, корни бамбука и миндаль. Токсический потенциал цианогенного растения зависит, главным образом, от того, насколько высокой будет концентрация цианида в организме человека в результате его употребления в пищу. У человека острая интоксикация цианидами может иметь следующие клинические признаки: учащение дыхания, падение кровяного давления, головокружение, головная боль, боль в животе, рвота, диарея, спутанность сознания, цианоз, сопровождаемый фибриллярными мышечными сокращениями и судорогой, после чего наступает терминальная кома. Смерть в результате отравления цианидами может происходить при достижении ими концентраций, превышающих метаболические способности конкретного организма.
Нежелательные реакции
При использовании муравьиной кислоты всегда необходимо четко следовать указаниям инструкции. Химическое соединение более 10% способно нанести большой вред для кожи человека. Если случайно принять раствор внутрь, то он полностью уничтожит слизистую желудка и пищевода. Вдыхание паров большой концентрации вызывает отеки органов дыхания и покраснения глаз, вплоть до полной слепоты.
Важно! Если высококонцентрированный раствор попал на открытый участок кожи, то место поражение необходимо смазать любым раствором щелочи.
Если метанол попал в организм, то он начинает распадаться на несколько опасных веществ, которые способны привести к полной слепоте. Медлить ни в коем случае нельзя. Необходимо сразу выпить этиловый спирт. Он будет своеобразным антидотом, который сумеет остановить нежелательную реакцию.
приложений
промышленные
-Уксусная кислота взаимодействует с этиленом в присутствии кислорода с образованием винилацетатного мономера, причем палладий используется в качестве катализатора реакции. Винилацетат полимеризуется в поливинилацетат, который используется в качестве компонента лакокрасочных материалов.
-Реагирует с различными спиртами для производства сложных эфиров, в том числе этилацетата и пропилацетата. Ацетатные эфиры используются в качестве растворителей для чернил, нитроцеллюлозы, покрытий, лаков и акриловых лаков.
-При конденсации двух молекул уксусной кислоты, теряя одну молекулу, образуется уксусный ангидрид, СН3CO-O-СОСНЫ3. Это соединение участвует в синтезе ацетата целлюлозы, полимера, который составляет синтетическую ткань и используется в производстве фотопленок..
В качестве растворителя
-Это полярный растворитель, способный образовывать водородные связи. Он способен растворять полярные соединения, такие как неорганические соли и сахара, но также растворяет неполярные соединения, такие как масла и жиры. Кроме того, уксусная кислота смешивается с полярными и неполярными растворителями..
-Смешиваемость уксусной кислоты с алканами зависит от их удлинения: по мере увеличения длины цепи алканов ее смешиваемость с уксусной кислотой уменьшается.
медицинская
-Разбавленная уксусная кислота используется в качестве антисептика, применяемого местно, обладающего способностью атаковать бактерии, такие как стрептококки, стафилококки и псевдомонады. Благодаря этому действию его используют при лечении кожных инфекций.
-Уксусная кислота используется в эндоскопии пищевода Барретта. Это состояние, при котором слизистая оболочка пищевода изменяется, становясь похожей на слизистую оболочку тонкой кишки..
-Гель из 3% -ной уксусной кислоты, по-видимому, является эффективным адъювантом для лечения вагинальным препаратом мизопростол, вызывая медикаментозный аборт в среднем триместре, особенно у женщин с рН влагалища 5 или более.
-Он используется в качестве заменителя химического пилинга. Тем не менее, осложнения возникли с этим использованием, так как сообщалось, по крайней мере, об одном случае ожогов, перенесенных пациентом..
В еду
Уксус долгое время использовался в качестве приправы и ароматизатора для еды, поэтому это наиболее известное применение уксусной кислоты.
Фуранокумарины
Эти токсины продуцируются разнообразными растениями, такими как пастернак (растение, родственное моркови и петрушке), корнеклубнях сельдерея, цитрусовых (лимон, лайм, грейпфрут, бергамот) и некоторые лекарственные растения. Фуранокумарины – токсины, вырабатываемые растением в ответ на раздражитель, например, физическое повреждение. У чувствительных людей эти токсины могут вызвать нарушения работы желудочно-кишечного тракта. Фуранокумарины обладают фотосенсибилизирующим действием и могут вызывать серьезные раздражения кожи под воздействием ультрафиолета. Чаще всего такие реакции возникают при попадания сока этих растений на кожу, однако описаны случаи аналогичного эффекта в результате употребления в пищу больших количеств овощей, богатых фуранокумаринами.
Применение
Применение уксусной кислоты достаточно разнообразное. В химической промышленности из нее производят пластические массы, различные красители, лекарственные вещества, искусственное волокно (ацетатный шелк), невоспламеняющуюся кинопленку и многие другие вещества. Соли уксусной кислоты — ацетаты алюминия, хрома, железа — применяют как протраву при окраске тканей. Уксусная кислота имеет широкое применение и в качестве растворителя.
В пищевой промышленности применяется как консервант, регулятор кислотности и вкусовая приправа; в Европейской системе пищевых добавок уксусная кислота имеет код E260.
Кислота применяется при солянокислотного обработке призабойной зоны пласта в качестве стабилизатора (с целью стабилизации продуктов реакции) от выпадения складновилучуваних гелеобразных соединений железа (осадка). В зависимости от содержания железа в кислотном растворе (от 0,01 до 0,5%) берут 1-3% уксусную кислоту. Для приготовления рабочих растворов используют как синтетическую кислоту, так и лесохимическую техническую очищенную.
Деятельность ВОЗ
ВОЗ в сотрудничестве с ФАО отвечает за оценку риска, который представляют природные токсины для человека в результате контаминации продуктов питания, и выработку рекомендаций по обеспечению необходимой защиты.
Оценка риска в связи с присутствием природных токсинов в продуктах питания выполняется Комитетом экспертов ФАО/ВОЗ по пищевым добавкам (JECFA) и используется правительствами стран и Комиссией Кодекс Алиментариус (нормативным межправительственным органом по пищевым стандартам) для определения предельных допустимых значений концентрации различных примесей в продуктах питания или выработки других рекомендаций по управлению рисками в интересах предотвращения или снижения контаминации. Стандарты Кодекса являются международным ориентиром для национальных производителей продовольствия и торговли продовольствием и призваны гарантировать потребителям во всем мире, что приобретаемые ими продукты питания соответствуют установленным стандартам безопасности и качества, где бы они ни были произведены.
JECFA устанавливает предельно допустимые уровни потребления различных природных токсинов.
В состав JECFA или специальных научных экспертных групп ФАО/ВОЗ входят независимые международные эксперты, которые проводят научные обзоры всех опубликованных исследований и других данных по отдельным природным токсинам. По итогам этой работы по оценке риска для здоровья устанавливаются либо предельные допустимые уровни потребления или формулируются другие рекомендации для обозначения степени опасности для здоровья (например, пределы экспозиции). Выдвигаются рекомендации относительно управления рисками и мер по предотвращению и снижению контаминации, а также аналитических методов и мероприятий по мониторингу и контролю.
Во избежание нанесения ущерба здоровью людей содержание природных токсинов в продуктах питания должно быть максимально низким. Природные токсины не только являются источником риска для здоровья человека и животных, но и негативно воздействуют на ситуацию с продовольственной безопасностью и питанием, поскольку ограничивают доступ людей к здоровой пище. ВОЗ настоятельно рекомендует национальным органам власти вести мониторинг содержания наиболее значимых природных токсинов в продовольственной продукции, реализуемой на их рынке, и принимать меры для максимального его сокращения и обеспечивать соблюдение международных рекомендаций по предельно допустимым значениям, условиям хранения и законодательству.
Свойства уксусной кислоты
Уксусная кислота в виде чистого CH3COOH представляет собой бесцветную жидкость, которая обладает сильно разъедающим и раздражающим действием. При смешивании с водой происходит контракция – в случае уксусной кислоты это значительное сокращение объема.
Уксусная кислота является гигроскопическим веществом, что означает, что она способна поглощать воду из различных источников. Данное свойство уксусной кислоты и способность воды растворяться в ней означает, что при открытии бутылки с кислотой содержащееся в ней вещество может даже затвердеть при контакте с влажным воздухом.
При низких температурах на поверхности уксусной кислоты образуются кристаллы, напоминающие лед. Это явление происходит только с чистой уксусной кислотой или при очень низких температурах, которым подвергается так называемая уксусная эссенция.
Важной особенностью уксусной кислоты является ее способность к диссоциации. Поскольку это карбоновая кислота, она диссоциирует и поэтому хорошо проводит электричество
Уксусная кислота также имеет очень высокую температуру кипения, что обусловлено химической структурой данного вещества.

Физические свойства
Уксусная кислота при стандартном состояния является бесцветной жидкостью с резким запахом. При замерзании при температуре 16,635 ° С, она превращается в прозрачные кристаллы (ледяная уксусная кислота).
| 25 ° C | 50 ° C | 75 ° C | 100 ° C | 110 ° C |
|---|---|---|---|---|
| 1,056 | 0,786 | 0,599 | 0,464 | 0,424 |
Уксусная кислота неограниченно смешивается с водой, образует значительное количество азеотропных смесей с органическими растворителями:
| Второй компонент | Температура кипения, ° C | Содержание кислоты,% | Содержание второго компонента,% |
|---|---|---|---|
| Гексан | 68,3 | 6,0 | 94,0 |
| Октан | 105,7 | 53,7 | 46,3 |
| Циклогексан | 78,8 | 9,6 | 90,4 |
| Бензол | 80,05 | 2,0 | 98,0 |
| Толуол | 100,6 | 28,1 | 71,9 |
| Етилбензен | 114,65 | 66 | 34 |
| Стирен | 116,8 | 85,7 | 14,3 |
| Пиридин | 138,1 | 51,1 | 48,9 |
| Тетрахлорметан | 76 | 98,46 | 1,54 |
| Хлоробензен | 114,7 | 58,5 | 41,5 |
| Нитроэтан | 112,4 | 30 | 70 |
Другие физические свойства:
- критическое давление 5,79 МПа;
- критическая температура 321,6 ° С;
- удельная теплоемкость 2 010 Дж / (кг · K) (при 17 ° С);
- поверхностное натяжение 27,8 · 10 -3 Дж / м² (при 20 ° С);
- коррозионная активность 10% -го водного раствора по отношению к ст. 3 2,97 г / (ч · м²) (20 ° С).
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии.
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины XX века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.


































